1,TNF受体信号通路简介
过量的慢性TNF产生是引发自身免疫疾病、纤维化以及心脏功能障碍的关键因素,同时在肿瘤的发生和发展中也起着重要作用。为应对这一挑战,各类TNF抑制性生物药物已经被开发出来,并在临床试验中用于治疗免疫相关疾病。尽管TNF抑制性生物药物在治疗某些适应症(如多发性硬化和心脏梗塞)方面效果不佳,但它们在应对其他由TNF驱动的疾病,如类风湿性关节炎、克罗恩病和牛皮癣,方面表现出显著疗效。
TNF除了TNF的有害促炎作用外,最新的研究数据还表明,TNF通过刺激调节性T细胞(Treg)、髓源性抑制细胞(MDSC)和调节性B细胞(通过产生IL-10),同样具有强大的免疫抑制活性。此外,TNF还促进了某些细胞类型的存活,包括少突胶质细胞、心肌细胞和角质形成细胞。
TNF通过两个结构相似的受体—TNFR1和TNFR2传递信号,两者都是TNF受体超家族(TNFRSF)的成员。虽然TNFR1在大多数细胞中普遍表达,但TNFR2的表达相对有限。TNFR2主要在髓系细胞、调节性T细胞(Treg)和B细胞中持续高水平表达,但在静止的T细胞、2型先天淋巴细胞(ILC2)以及一些非造血细胞(如间充质干细胞、内皮细胞和上皮细胞)中也存在低水平表达。各种促炎性细胞因子,如IL-33、IFNγ、IL-1、TL1A和TNF本身,还能进一步增强TNFR2在免疫细胞和非免疫细胞中的表达,尤其是在类风湿性关节炎患者的成纤维样滑膜细胞中。
TNFR1具有强大的促炎信号传导能力,但也能够通过诱导细胞凋亡、坏死性凋亡,以及促进活性氧(ROS)的生成或激活酸性鞘磷脂酶,从而引发依赖于具体环境的细胞死亡。TNF抑制剂在治疗自身免疫疾病中的显著临床成功,主要得益于其抑制TNFR1促炎作用的能力。然而,较少被研究的TNFR2同样具有促炎作用。例如,TNFR2能够共刺激CD8+ T细胞,维持树突状细胞的存活和持久性,并通过诱导内皮细胞表面E-选择素、VCAM1和ICAM1的表达,促进白细胞的内皮迁移。
TNFR2在调节性T细胞(Treg)、髓源性抑制细胞(MDSC)、产生IL-10的B细胞以及心肌细胞中还具有多种抗炎和保护作用。在此背景下,TNFR1特异性抑制剂和TNFR2特异性激动剂有潜力将TNF驱动的免疫介导疾病的平衡从抑制TNFR1的“有害”活动倾向于增强TNFR2的“有益”活动。
1.1 TNF受体与配体结合及聚集
TNF最初以II型跨膜分子形式表达,包括可溶性TNF(sTNF)和膜结合TNF(memTNF)两种存在形式,sTNF是由膜结合TNF(memTNF)经过ADAM17在柄区切割后从膜结合形式释放的。两种TNF受体都以亚纳摩尔级别的亲和力结合sTNF,但只有TNFR1的信号传导能够被sTNF强烈且全面地激活;而memTNF能够同时有效刺激TNFR1和TNFR2的信号传导。
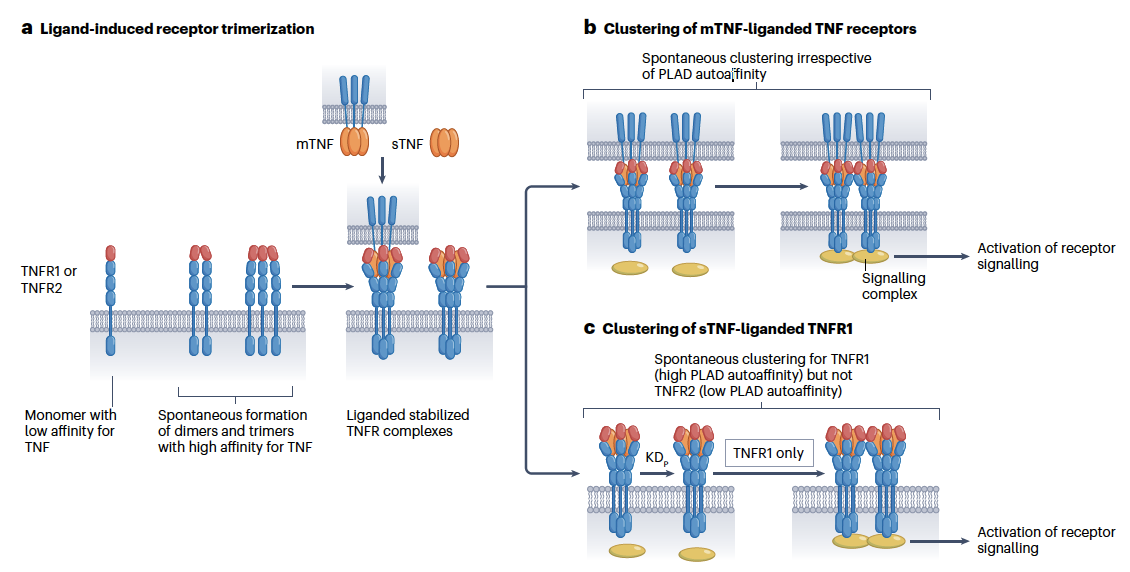
TNFR1和TNFR2的激活首先涉及配体诱导的受体三聚化,即使在没有配体的情况下,TNFR1和TNFR2分子也会通过它们的PLADs结构域(下图中以红色表示)短暂地自我结合成二聚体和三聚体。TNF三聚体优先与这些不活跃且不稳定的受体二聚体或受体三聚体相互作用,形成稳定的配体结合的TNFR1或TNFR2复合物。然而稳定的、配体结合的TNFR1和TNFR2三聚体并不足以触发有效的信号传导。
TNFR1和TNFR2激活的一个重要步骤是结合配体后的受体三聚体的进一步聚集。由于在细胞-细胞接触区域的局部高分子浓度,mTNF结合的TNFR1和TNFR2三聚体通过其PLAD在细胞外空间自发聚集;这一过程在很大程度上与PLAD-PLAD相互作用的亲和力(KDP)无关。对于sTNF结合的TNFR1,PLAD的相对较高的自亲和力使得TNFR1三聚体能够自发进行二次聚集。然而,对于sTNF-配体结合的TNFR2,PLAD的自亲和力太低,无法促进有效的受体聚集。
除了两种形式的TNF外,TNFSF的其他配体也可以与TNFR1和TNFR2相互作用,包括同源三聚体淋巴毒素α(LTα,也称为TNFβ)和可溶性及膜结合的LTα2-LTβ异源体。
1.2 TNF诱导的信号通路
尽管TNFR1和TNFR2的细胞外结构域结构相似,但这两个TNF受体属于TNFRSF的两个不同的结构和功能相关的亚组,因此而至下游信号通路也存在差异。
TNFR1信号传导:
TNFR1的激活可以通过两种主要的细胞内复合物启动信号传导。复合物I负责激活增殖和细胞因子生成的经典核因子κB(NF-κB)和丝裂原活化蛋白激酶(MAPK)通路,而复合物II则负责程序性细胞死亡。TNF结合导致TNFR1的细胞内死亡域(DD)发生构象变化,从而招募TNFR1相关死亡域(TRADD)、TNF相关因子2或5(TRAF 2/5)以及受体相互作用丝氨酸/苏氨酸蛋白激酶1(RIPK1),共同形成复合物I。该复合物的特征是由细胞凋亡抑制蛋白1和2(cIAP1/2)以及线性泛素组装复合物(LUBAC)对RIPK1进行泛素化。复合物I的激活招募IκB激酶(IKK)复合物和TGF-β激活激酶1(TAK1)复合物,分别导致NF-κB和MAPK通路的激活,从而启动促炎和细胞存活蛋白的转录。关于复合物I激活的实际机制仍不清楚,因为有研究表明RIPK1的泛素化可能不是必需的。
当RIPK1的泛素化不存在或被移除时,复合物II在细胞质中形成。已经提出了三种不同的复合物II亚型;在复合物IIa和IIb中,RIPK1与其他支架蛋白从膜上解离并激活Caspase8,导致Caspase级联反应和凋亡。复合物IIc在Caspase8不可访问或激活不足时形成。此时,磷酸化的RIPK1与RIPK3形成坏死小体,进一步激活混合谱系激酶结构域样(MLKL)蛋白,导致程序性坏死。体内研究表明,复合物I和复合物IIc在自身免疫疾病的慢性炎症状态中起作用,并且Caspase8的活性可以减弱炎症反应。
TNFR2信号传导:
TNFR2激活的结果主要是细胞增殖和细胞存活。TNFR2缺乏死亡域(DD),因此不与TRADD相互作用。相反,TRAF蛋白与TNFR2的细胞内部分形成复合物,并招募cIAP1/2。TNFR2激活下游涉及多条信号通路,包括磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)通路、p38 MAPK通路以及通过NF-κB诱导激酶(NIK)激活的非经典NF-κB通路,后者启动与TNFR1依赖的NF-κB激活转录的基因不同的基因转录。此外,TNFR2复合物的泛素化与经典NF-κB激活相关,表明其具有类似于TNFR1激活所形成的复合物I的促炎反应。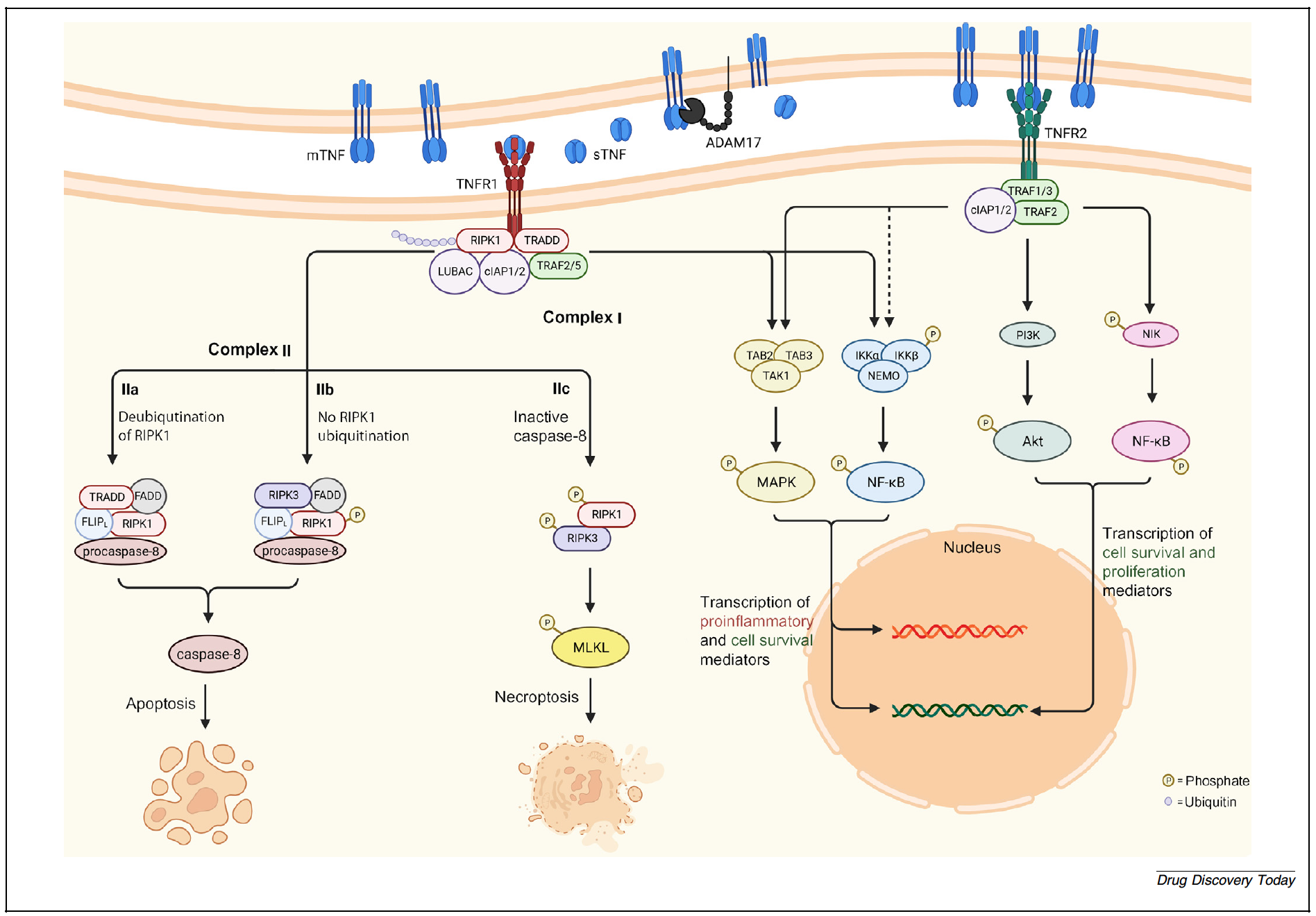
2,已上市TNF靶向药物
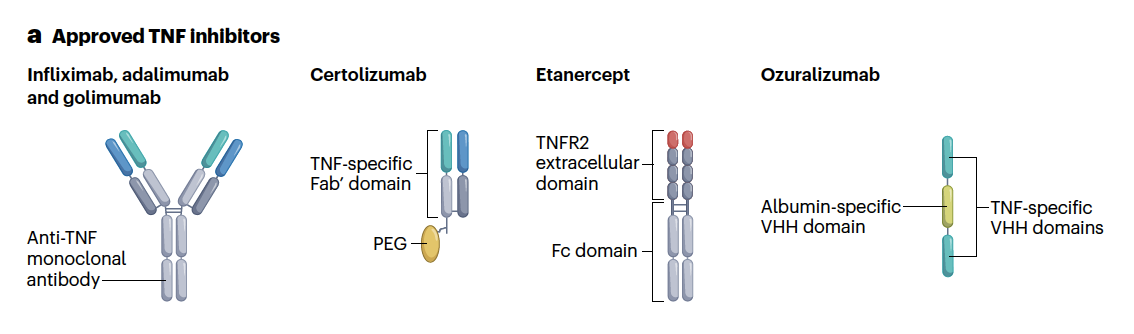
目前,有6种抑制TNF/TNF受体信号通路的生物药获批上市:
- 三种IgG1抗体:英夫利昔单抗、阿达木单抗和戈利木单抗,
- 聚乙二醇化Fab2片段:赛妥珠单抗,
- 三价纳米抗体结构:奥佐利珠单抗(由两个TNF特异性VHH结构域和一个人血清白蛋白特异性VHH结构域组成)
- 融合蛋白:依那西普(由TNFR2的胞外结构域和人IgG1抗体的Fc蛋白组成)。
其中五种抗体变体都结合TNF并阻止其与两种TNF受体的结合,但不干扰LTα和LTα2β异源三聚体的受体结合。因此存在残余的由LTα及LTα2β异源三聚体介导的TNF受体激活,但这种持续的激活是否限制了TNF阻断抗体在风湿性疾病和/或其他TNFR1驱动疾病中的临床疗效,研究较少且大多不明确。
在一项研究中,约22%的类风湿性关节炎(RA)患者的血清中检测到LTα,而健康个体的血清中不存在LTα;此外,RA患者的滑膜成纤维细胞在体外对TNF和LTα有类似的反应。这些观察结果表明,LTα在RA的发病机制中与TNF一起发挥作用。
然而,在一项II期随机对比研究中,阿达木单抗和抗LTα抗体帕特克利珠单抗相比,帕特克利珠单抗未能达到主要终点(12周时的4变量28关节病活动评分-红细胞沉降率反应),仅达到8个次要终点中的2个。不幸的是,没有研究评估LTα抑制剂治疗与TNF抑制剂治疗结合的效果。
在一种移植物抗宿主病的小鼠模型中,缺乏TNF或LTα的移植物(但不是缺乏LTβ的移植物)诱导疾病的能力减弱,表明在这种炎症情况下,TNF和LTα可以冗余地促进疾病。依那西普结合TNF、LTα和LTα2β异源三聚体,因此目前是唯一理论上可以完全阻断TNFR1和TNFR2信号传导的TNF抑制剂。
多项RA患者研究表明,依那西普治疗对那些对英夫利昔单抗或阿达木单抗治疗无效或对这些试剂的初始反应减弱的患者有益。这种效果可能至少部分反映了LTα在疾病中的作用,但其他不太明显的机制也可能有所贡献。事实上,有些对依那西普治疗无反应的患者可以有效地用英夫利昔单抗治疗,尽管这种药物不阻断LTα。三种抗TNF IgG1抗体和IgG1 Fc融合蛋白依那西普以低亲和力结合FcγRI、FcγRIIa、FcγRIIIa和FcγRIIb。TNF的结合增加了抗TNF抗体(但不是依那西普)对FcγRIIa/b和FcγRIII的亲和力,使得在表达memTNF的细胞中诱导抗体依赖性细胞介导的细胞毒性(ADCC)。类似地,三种抗TNF IgG1抗体与memTNF结合触发补体依赖性细胞毒性(CDC)。抗TNF抗体结合后的memTNF反向信号传导也可能促进表达memTNF的细胞的死亡。然而,ADCC、CDC和反向memTNF信号的诱导在各种TNF中和生物药物的治疗效果中的贡献程度尚不清楚。
靶向TNF生物药物因为其生产需要复杂的制造程序和温控供应链,导致生产成本高昂。另外一个主要问题是,尤其是单克隆抗体,反应不一致。在风湿病患者中,10-30%初始反应不足,这被认为是由于凋亡相关蛋白如胱天蛋白酶9的突变或TNFR1和TNFR2信号传导的非选择性抑制。此外,许多患者会出现时间依赖性的反应丧失(LOR)。在54周后,患有CD的患者中观察到英夫利昔单抗的LOR为13.1%。通常,LOR是由于免疫原性,包括抗药抗体。使用单克隆抗体还常见过敏反应,从注射部位的局部皮肤刺激到潜在致命的过敏反应。此外,抗TNF生物制剂治疗还报道了罕见但严重的血小板减少症。生物制剂的药代动力学特性也存在问题,因为其分子尺寸限制了口服吸收,药物必须通过侵入性途径给药。这需要医护专业人员的协助,对于有针头恐惧症和儿童患者来说是个问题。此外,这些药物无法分布到中枢神经系统,因此不能用于治疗神经退行性疾病,因此口服小分子的开发逐步成为研发的热的。

3,在研靶向TNF/TNFR药物
3.1 SAR441566
- SAR441566通过扭曲可溶性TNFα三聚体的构象,干扰TNFR1信号传导,抑制TNFR1介导的促炎性细胞因子释放和细胞死亡。这意味着SAR441566能够选择性地抑制TNFR1信号,而不影响TNFR2的功能。TNFR2在组织修复、感染防护以及调节性T细胞扩展中发挥作用,因此SAR441566的选择性作用有助于减少副作用,同时保留TNFR2的有益功能。
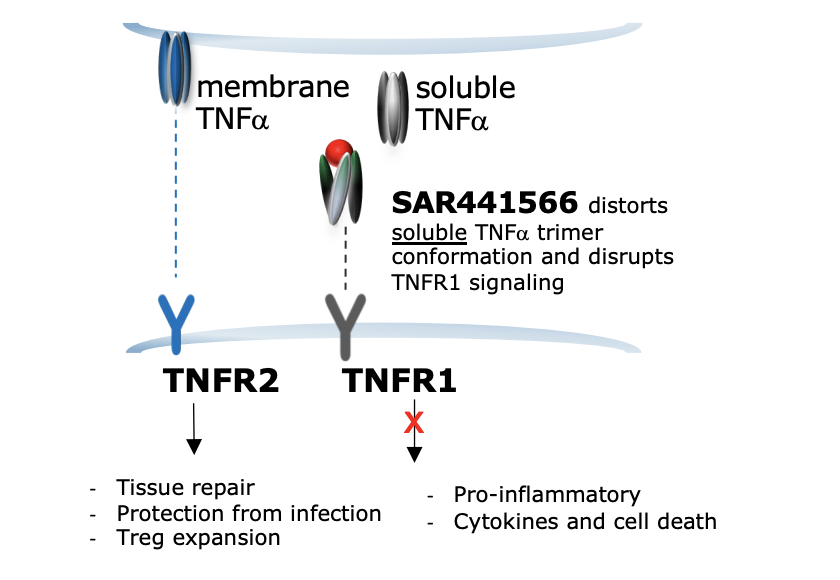
- SAR441566作为TNFR1信号的选择性抑制剂,有潜力降低感染风险并提高疗效。它能够满足多个大市场(如类风湿性关节炎、银屑病和炎症性肠病)的患者需求,展现了广泛的适应症潜力。
- SAR441566具有多种有利的药代动力学性质,包括高组织分布、低代谢清除率以及适中的生物利用度。这些特性表明该药物适合每日口服给药,并且可能具有与生物制剂相似的疗效。在临床前研究中,SAR441566在胶原诱导的关节炎(CIA)小鼠模型中表现出显著的抗关节炎效力,且该效力与抗体治疗相当。
- SAR441566在1b期银屑病临床试验中显示出疗效,并且耐受性良好,没有严重的不良事件。该药物展现出作为全口服组合疗法潜在基础的强大应用前景。
|
项目名称 |
SAR441566 |
|
分子类型 |
小分子 |
|
公司 |
赛诺菲 |
|
研发阶段 |
临床II期 |
|
临床代码 |
银屑病:NCT06073119 类风湿关节炎:NCT06073093 |
|
作用机制 |
sTNF抑制剂 |
|
临床周期 |
NCT06073093:2023-11-07到2025-08-08 NCT06073119:2023-10-26到2025-05-08 |
|
潜在适应症 |
银屑病,类风湿关节炎 |
3.2 XPro1595
- XPro1595特异性中和sTNF,阻止其与TNFR1的结合,从而抑制sTNF介导的炎症级联反应。这种选择性抑制机制使得XPro1595能够减少神经炎症,同时保留mTNF-TNFR2途径的有益功能,如组织修复和神经保护。
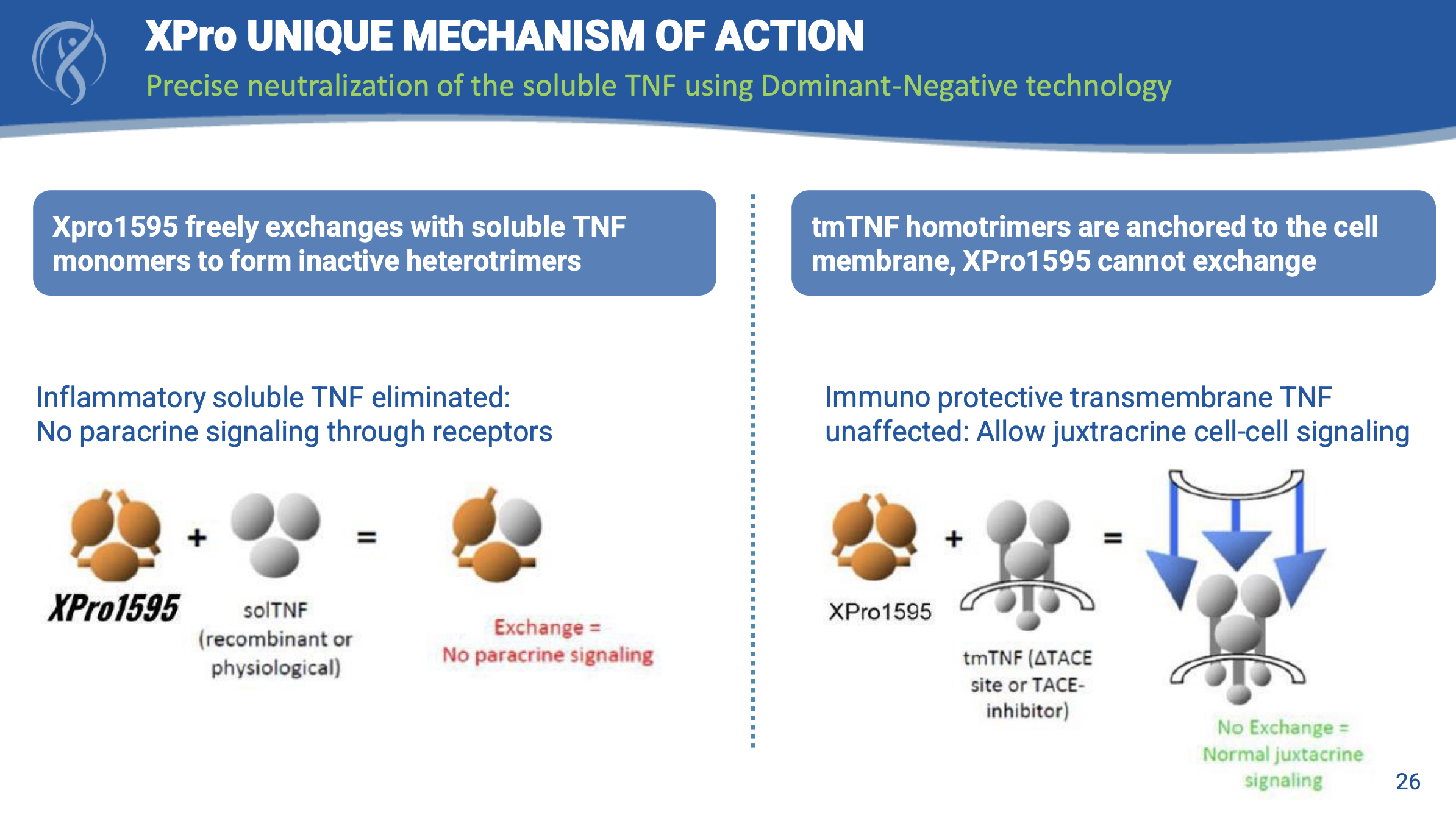
- XPro1595 针对大脑中的微胶质细胞和星形胶质细胞,这些细胞在阿尔茨海默病等神经退行性疾病中被激活并引发炎症反应。sTNF 是炎症级联反应中的关键因子,XPro1595 通过中和 sTNF 来抑制这些细胞的活化,从而减轻神经炎症,改善突触功能并促进髓鞘修复。
- 临床开发方面:
- 阿尔茨海默病 (AD):XPro1595 已经完成了一项 I 期临床试验,结果显示该药物能够安全地减少伴有慢性炎症标志物的 AD 患者的大脑炎症。基于这些数据,目前正在全球多个国家(包括澳大利亚、加拿大、英国、西班牙、法国、德国、波兰、捷克共和国和美国)进行 II 期随机双盲安慰剂对照试验,目标是在早期 AD 患者中验证其疗效。
- 难治性抑郁症 (TRD):XPro1595 也正在为 TRD 患者准备 II 期临床试验,这些患者通常表现出慢性全身性炎症。该试验将利用外周炎症生物标志物来选择适合治疗的患者。
- 潜在的其他应用:除了 AD 和 TRD,XPro1595 还被探索用于治疗杜氏肌营养不良症 (DMD) 和其他神经退行性疾病。预临床研究表明,XPro1595 可以通过降低炎症和促进肌肉再生来改善 DMD 患者的病情。
|
项目名称 |
XPro1595 |
|
分子类型 |
重组蛋白 |
|
公司 |
Inmunebio |
|
研发阶段 |
临床II期 |
|
临床代码 |
阿尔茨海默:NCT05522387,NCT05318976 |
|
作用机制 |
sTNF抑制剂 |
|
临床周期 |
NCT05522387:2023-02-21到2024-12-31 NCT05318976:2022-02-28到2025-04-30 |
|
潜在适应症 |
阿尔茨海默 |
3.3 HFB200301
TNFR2主要表达在免疫细胞上,包括效应CD8+和CD4+T细胞、调节性T细胞(Treg)、自然杀伤(NK)细胞和髓系细胞上。相比之下,TNFR1在大多数细胞类型中普遍表达。
HFB200301是一种激动性单克隆抗体,靶向TNFR2,旨在刺激先天和适应性免疫反应,特别是在肿瘤微环境中激活T细胞和NK细胞,以增强抗肿瘤免疫反应。当前的I期多中心剂量递增试验正在评估其单药和联合使用抗PD-1抗体tiselizumab的疗效。

HFB200301展现出良好的安全性,并在单药和与TIS联合治疗中表现出剂量依赖的药代动力学(PK)、药效学(PD)以及初步的临床活性。基线数据、治疗期间的患者及肿瘤特征、PK和PD数据表明,更频繁的每两周一次(Q2W)给药可能更为有效。随着剂量方案和预测生物标志物的优化,预计在特定肿瘤扩展队列中会看到更好的临床反应。
|
项目名称 |
HFB200301 |
|
分子类型 |
抗体 |
|
公司 |
HiFiBiO Therapeutics |
|
研发阶段 |
临床I期 |
|
临床代码 |
实体瘤:NCT05238883 |
|
作用机制 |
TNFR2激动抗体 |
|
临床周期 |
NCT05238883:2022-03-10到2026-12 |
|
潜在适应症 |
实体瘤 |
3.4 BI-1808
BI-1808是一种首创的人源化IgG1单克隆抗体,靶向TNFR2。它通过阻断TNFR2与其配体TNF-α的结合,削弱肿瘤内Treg细胞的功能,并扩增肿瘤内CD8+T细胞。在免疫健全的小鼠肿瘤模型中,BI-1808通过FcγR依赖性机制清除肿瘤内Treg细胞,并且在与抗PD-1抗体联合使用时,能在对免疫检查点抑制剂敏感性中等的小鼠中实现完全治愈,表明该联合疗法可能具有协同效应。
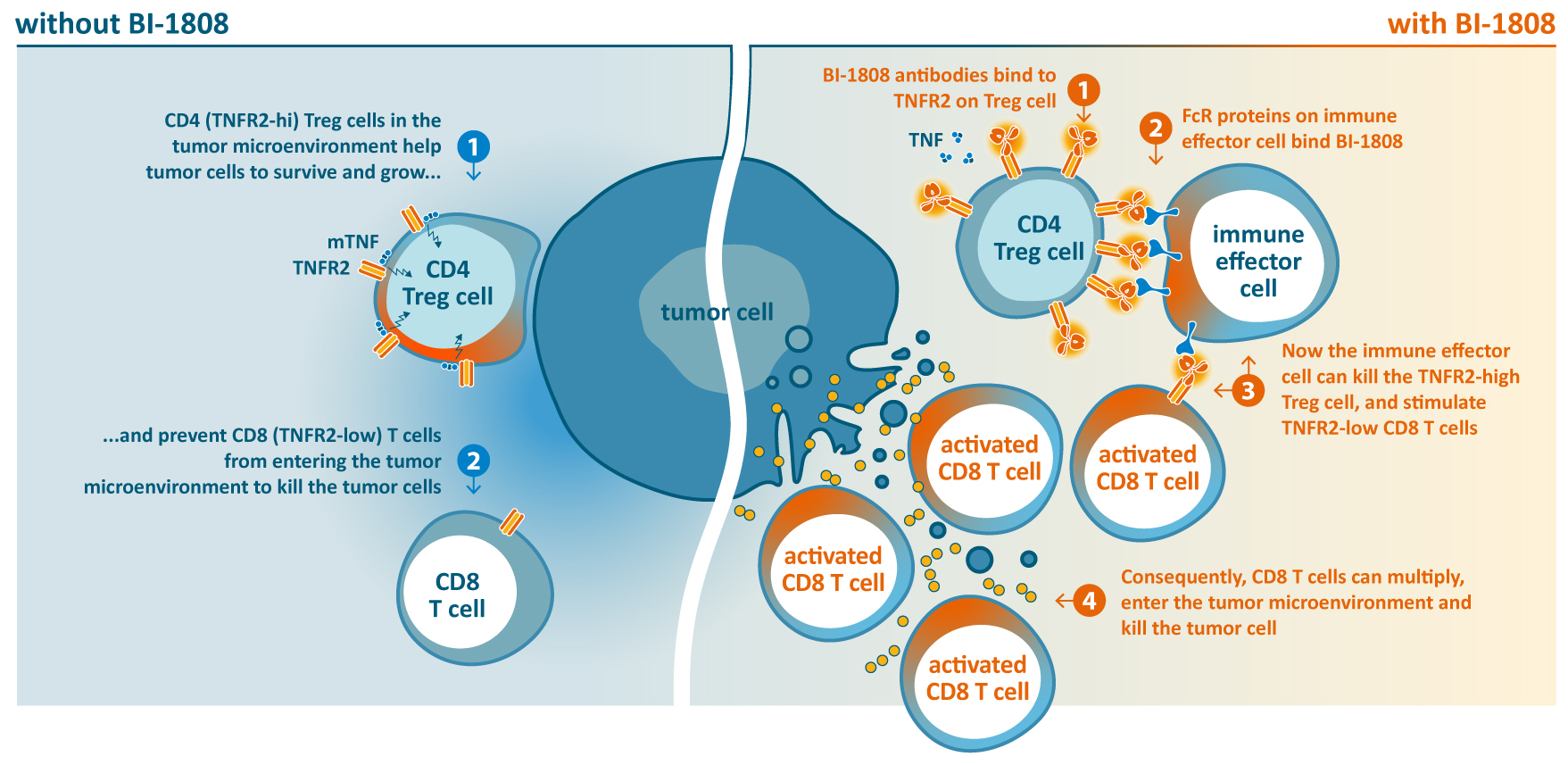
来自BI-1808单药治疗组的初步数据显示,该药物在临床试验的1期A部分中取得了令人鼓舞的结果。BI-1808显示出良好的安全性,在单药治疗组中未观察到剂量限制性毒性(DLT),且在所有研究剂量水平上耐受性良好。在接受多次治疗的患者群体中,目前在一名胃肠道间质瘤(GIST)患者中观察到显著的部分缓解,并且在21名可评估患者中有7名实现了疾病稳定(SD)。PK/PD数据帮助确定了一个广泛的剂量范围,能够实现完全靶点覆盖,并具有良好的安全性。
|
项目名称 |
BI-1808 |
|
分子类型 |
抗体 |
|
公司 |
Bioinvent |
|
研发阶段 |
临床I/IIa期 |
|
临床代码 |
晚期恶性肿瘤:NCT04752826 |
|
作用机制 |
TNFR2激动抗体 |
|
临床周期 |
NCT04752826:2021-01-25到2026-12-15 |
|
潜在适应症 |
晚期恶性肿瘤 |
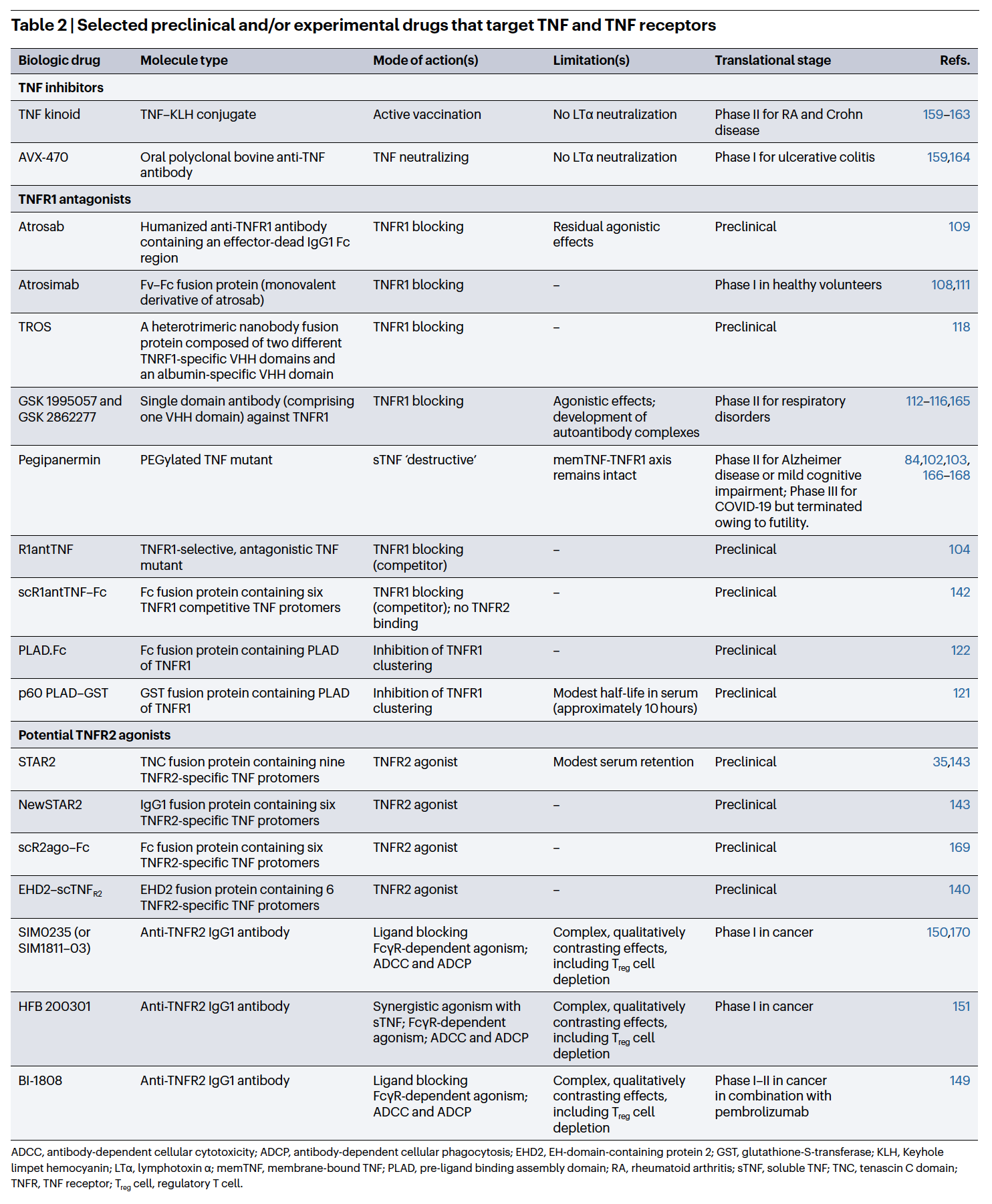
以下表格总结了在研的TNF及TNFR靶向药物:
4,参考资料
- Siegmund, Daniela, and Harald Wajant. “TNF and TNF receptors as therapeutic targets for rheumatic diseases and beyond.” Nature reviews. Rheumatology vol. 19,9 (2023): 576-591. doi:10.1038/s41584-023-01002-7
- Chédotal, Henri et al. “Small-molecule modulators of tumor necrosis factor signaling.” Drug discovery today vol. 28,6 (2023): 103575. doi:10.1016/j.drudis.2023.103575

